 Группе специалистов из Северо-Западного университета (Northwestern University, Чикаго, США) удалось выключить ген, ответственный за рост и устойчивость глиобластомы - неизлечимой, наиболее агрессивной злокачественной опухоли головного мозга. Добиться такого результата позволило применение разработанных авторами наночастиц сферической формы с золотыми сердечниками, доставляющих в клетки мозга малые интерферирующие РНК, запрограммированные на понижение экспрессии онкогена. Результаты исследования опубликованы в журнале Science Translational Medicine.
Группе специалистов из Северо-Западного университета (Northwestern University, Чикаго, США) удалось выключить ген, ответственный за рост и устойчивость глиобластомы - неизлечимой, наиболее агрессивной злокачественной опухоли головного мозга. Добиться такого результата позволило применение разработанных авторами наночастиц сферической формы с золотыми сердечниками, доставляющих в клетки мозга малые интерферирующие РНК, запрограммированные на понижение экспрессии онкогена. Результаты исследования опубликованы в журнале Science Translational Medicine.
Диагноз «мультиформная глиобластома» сейчас означает летальный исход через 14-16 месяцев после его постановки. Неизлечимость этого вида ракового заболевания обуславливается, в том числе, его устойчивостью к химиотерапии ввиду сложности доставки лекарственных веществ в мозг, который отделен от крови гематоэнцефалическим барьером. Этот барьер, как правило, не способны преодолеть даже вещества с низкой молекулярной массой.
В то же время в последние годы был выявлен ряд онкогенов, обуславливающих агрессивность глиобластомы и являющихся потенциальными целями генной терапии, в том числе ген Bcl2Like12, гиперэкспрессия которого в клетках опухоли и, соответственно, избыток кодируемого этим геном белка поддерживает рост глиобластомы.
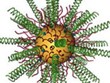
Для решения проблемы доставки препаратов генной терапии в клетки опухоли была использована разработка ведущего автора работы, специалиста по наномедицине Чэда Миркина (Chad A. Mirkin), сделанная им еще в 1996 году - сферические нуклеиновые кислоты (spherical nucleic acids, SNA). Они представляют собой крошечные сферы, в качестве сердечников в которых использованы золотые наночастицы 13 нанометров в диаметре. Сердечники плотно окружены малыми интерферирующими РНК (siRNA) - короткими двухцепочечными РНК, специально запрограммированными в данном случае на понижение экспрессии Bcl2Like12. Ключевой в данном случае является именно сферическая форма SNA, а также их плотность и очень маленький размер. Все эти параметры позволяют им преодолевать гематоэнцефалический барьер, проникать в злокачественные клетки и выключать онкоген.
Эксперименты на мышиной модели глиобластомы показали, что системное внутривенное введение SNA приводит значительному снижению экспрессии Bcl2Like12 в глиальных раковых клетках и их апоптозу. Авторы отметили почти 20-процентное повышение уровня выживаемости больных животных, а размер опухоли у них снизился в три-четыре раза по сравнению с контрольной группой. При этом негативных побочных эффектов применения SNA отмечено не было. Следующим шагом должно стать испытание этой методики на людях.
По мнению Миркина, успех применения SNA in vivo может стать платформой для генной терапии широкого спектра заболеваний, от рака легких и толстой кишки, до ревматоидного артрита и псориаза.