На мировом рынке клинических исследований (КИ) Россия по сравнению с развитыми странами по-прежнему занимает позицию аутсайдера, хотя и с некоторой перспективой.
На мировом рынке клинических исследований (КИ) Россия по сравнению с развитыми странами по-прежнему занимает позицию аутсайдера, хотя и с некоторой перспективой.
Многие западные компании заинтересованы в том, чтобы проводить у нас свои исследования. И вовсе не потому, что они обходятся дешевле - это один из мифов. Главное наше преимущество заключается в том, что хорошо идет набор пациентов, поскольку население большое, а не получавших лечение пациентов, к сожалению, много.
Что же касается цен, то с европейским уровнем мы уже сравнялись. Причина в том, что у нас по сравнению с развитыми странами дорогая логистика: одно дело перевезти биообразцы из одной страны в другую в Европе. Другое дело, когда нам нужно за 24-48 часов отправить их из России в Европу. Это, как правило, авиатранспорт, это таможенные расходы и оплата НДС, когда препарат приходит сюда. Потому что во многих странах НДС на лекарства для клинических исследований - 0%, а у нас сейчас 10%, а был 18%. Когда речь идет о дорогостоящих препаратах (для той же онкологии, например), это выливается в круглые суммы. У нас дороже обходится и мониторинг КИ, поскольку, как правило, его проводят специалисты с высшим медицинским образованием. А поручить его среднему персоналу, как это делают на Западе, невозможно, потому что вся документация оформляется на английском языке.
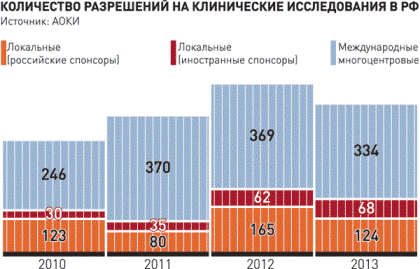
По количеству международных КИ мы значительно отстаем от развитых стран. Так, в США сейчас проходят 16 тысяч, в Европе почти 12 тысяч, у нас всего около 500. Почему мы не используем весь свой потенциал? Тут целый ряд причин. В первую очередь это недоверие со стороны компаний, которое часто связано с нестабильностью ситуации. В истории рынка КИ в нашей стране были периоды, когда не вполне продуманные шаги со стороны регуляторов приводили к тяжелым последствиям. Так, в 2007 году был остановлен вывоз образцов, и рынок стоял фактически два месяца. Непонятная, немотивированная и быстрая смена правил игры пугает компании, которые были бы заинтересованы в проведении у нас своих КИ. Другой сдерживающий фактор - это медлительность принятия административных решений, в частности, срок выдачи разрешений на КИ. В Европе он установлен на законодательном уровне и составляет 60 дней. У нас, к сожалению, на практике занимает до 120 дней. Почему так важны сроки? Дело в том, что нередко проводятся КИ с конкурентным набором сразу в пяти или десяти странах, и всего нужно набрать две тысячи пациентов. Штаб-квартиру компании не интересует, сколько человек будет набрано конкретно в каждой стране. Как только набирают две тысячи, набор закрывается. За то время, пока в России оформляют разрешение, может случиться, что наши пациенты уже не нужны. Кроме того, мы нередко сталкиваемся с отказом в разрешении. И особенно обидно компаниям, когда отказ дается не вполне грамотно, то есть возникают не предусмотренные законом вопросы от регулятора или Совета по этике. Порой компании делают и второй заход за разрешением, и третий, а в результате мы просто опаздываем. И теряем не только возможность получать новейшие препараты, но и деньги, и возможность повышать уровень квалификации медицинских работников, которые участвуют в КИ.
Ситуация с локальными клиническими исследованиями у нас вроде бы лучше, но она тоже вызывает определенное беспокойство. Больше всего вопросов вызывают локальные регистрационные исследования, которые были введены в связи с принятием Федерального закона "Об обращении лекарственных средств". Регулятор объявил их обязательными, но при этом не определил, в каком объеме. И это стало большой проблемой. Для регистрации в развитых странах нужно набрать для КИ тысячи больных. Понятно, что повторить такие же исследования в России просто невозможно и выборка будет меньше. Но в таком случае мы не достигаем статистической достоверности, и научная составляющая таких исследований под большим сомнением.
Столкнувшись с необходимостью проведения локальных исследований, компании идут разными путями. Западные по возможности стараются от них воздерживаться. Они стараются подключать Россию к какому-то международному исследованию, не желая дополнительно тратить деньги. Получилось, что мы воздвигли перед производителем лишний барьер для выхода на наш рынок. И перед ним не стоит задача выполнения международных стандартов, а появляется задача преодоления этого барьера и удовлетворения запроса чиновника.
Естественно, компании стараются идти по пути наименьшего сопротивления, и рынок локальных КИ иностранных спонсоров практически стоит, а регистрация препаратов задерживается, по самым скромным подсчетам, на 2-3 года. А кто-то и вообще решает ее отложить, пока ситуация не изменится.
Рост КИ произошел неожиданно для нас в секторе дженериков - это в первую очередь исследования биоэквивалентности. Однако дженерики загнали не только на повторные исследования биоэквивалентности, но и на исследования терапевтической эквивалентности, что само по себе абсурдно. В развитых странах, если лекарственная форма препарата (например, таблетка) позволяет проводить исследование биоэквивалентности, то оно и проводится. А если лекарственная форма не позволяет, то ограничиваются лишь совпадением состава и не проводят псевдоисследования терапевтической эквивалентности.
 Оптимальным был бы подход, используемый в развитых странах. Если в дженериках доказано соответствие по составу, если показана биоэквивалентность - скорость всасывания и выведения, достижения системного кровотока и т. д., - этого хватает, чтобы дженерик получил право выйти на рынок. В локальных исследованиях на 100 пациентах, где нет контроля со стороны регуляторных органов других стран, гарантировать достоверность результата невозможно. Выход сомнительного дженерика это ненамного отсрочит, но потом он вооружится документальным подтверждением своей "эквивалентности". Что за этим документальным подтверждением стоит, мы никогда не узнаем. Но оспорить, работает ли этот препарат или не работает, будет уже сложно.
Оптимальным был бы подход, используемый в развитых странах. Если в дженериках доказано соответствие по составу, если показана биоэквивалентность - скорость всасывания и выведения, достижения системного кровотока и т. д., - этого хватает, чтобы дженерик получил право выйти на рынок. В локальных исследованиях на 100 пациентах, где нет контроля со стороны регуляторных органов других стран, гарантировать достоверность результата невозможно. Выход сомнительного дженерика это ненамного отсрочит, но потом он вооружится документальным подтверждением своей "эквивалентности". Что за этим документальным подтверждением стоит, мы никогда не узнаем. Но оспорить, работает ли этот препарат или не работает, будет уже сложно.
Сейчас готовятся к рассмотрению в Госдуме поправки к Закону "Об обращении лекарственных средств". В них есть ряд новых понятий, в том числе и такое, как "препарат сравнения". У нас оно трактуется исключительно как оригинальный препарат. Но в международной практике есть два определения препарата сравнения. Есть reference product - это препарат, который используется как референсный (эталонный, контрольный) для сравнения с ним дженерика. А есть понятие comparator product - это препарат сравнения (прототип, исследуемый), который используется в клинических исследованиях. Причем "компаратором" может быть как зарегистрированный, так и незарегистрированный препарат, и даже плацебо. Понятно, что речь идет о двух разных предметах, но на русский язык оба термина могут быть переведены как "препарат сравнения". И когда в законопроекте написали, что препарат сравнения - это зарегистрированный препарат, причем по полному досье были опасения, что может произойти смешение двух понятий. Это поставило бы под вопрос возможность сравнивать препарат в клинических исследованиях с незарегистрированными препаратами и плацебо. Но на самом деле эта проблема легко решается. Определение препарата сравнения в КИ не требуется - оно уже есть в национальном стандарте, оно есть на практике. Главное, чтобы было корректно определено понятие препарата сравнения, которое используется для регистрации дженериков. Надеемся, законодатель учтет эти замечания.
Однако предлагаемый вариант поправок к 61-ФЗ все существующие для клинических исследований проблемы не решает. В минздрав неоднократно направлялись предложения о том, как улучшить ситуацию. Например, в части страхования пациентов, участвующих в КИ. С отдельными предложениями минздрав соглашался, потом какое-то из ведомств это положение не согласовало. Вместо того чтобы обсудить и понять, в чем разногласия, оказалось легче от них вовсе отказаться. Все же мы надеемся, что законопроект не усложнит ситуацию с КИ. Об улучшении в области организации и проведения КИ, к сожалению, пока речь не идет.
Источник: "Российская газета", Светлана Завидова (исполнительный директор Ассоциации организаций по клиническим исследованиям (АОКИ))